morfoloogia
Makroskoopilisel tasemel võib Alzheimeri tõve puhul täheldada muutuvat kortikaalset atroofiat (koe või elundi masside vähenemist), mida iseloomustab parietaalse vagude laienemine, mis on rohkem esile tõstetud eesmise, ajalise ja parietaalse lobes. Seda atroofiat kompenseerib vatsakeste õõnsuste suurenemine, mis on sekundaarne parenhüümi kadumise tõttu (joonis 1). Eriti haiguse edasijõudnute staadiumis on ajaline keskosa, kaasa arvatud hippokampus, entornaalne ajukoor ja amygdala, tugevalt atroofia, arvestades nende kaasamist patoloogia varajastest etappidest.
Peale selle esitab Alzheimeri tõbi ka mikroskoopilised muutused, mida tuntakse kui ekstratsellulaarseid seniilseid naastusid ja intratsellulaarseid neurofibrillaarseid klastreid, mis kujutavad endast histoloogilise diagnoosi alust. Haiguse progresseerumisega kaasneb tõsine närvikahjustus, millega kaasneb glioos (neuroglia rakkude piiratud iseloomuga või difuusne proliferatsioon, reaktiivne, st rakud, mis moodustavad närvikoe tugistromos) samades piirkondades. kus neurofibrillaarsete naastude ja klastrite olemasolu on suurem.
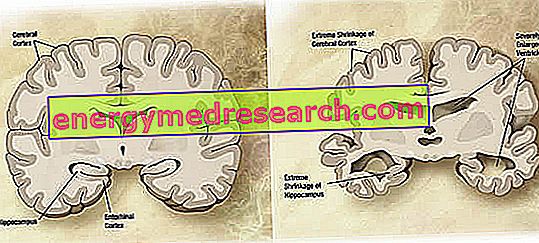
Joonis 1. Aju koronaalne osa: AD (wikipedia image source) mõjutatud aju ja aju vahelised erinevused.
patogenees
Alzheimeri tõbi iseloomustab peamiselt kaks tüüpilist kahjustust: seniilse naastude ekstratsellulaarne akumulatsioon, mis koosneb peamiselt β-amüloidpeptiidist (Aβ) ja intraneuronaalsetest neurofibrillaarsetest klastritest, mille moodustavad hüperfosforüülitud tau valk.
- Seniilseid naaste võib leida aju piirkondade, näiteks hipokampuse, amygdala ja neokortexi tasemel.
Ap-peptiid pärineb amüloidvalgu prekursori (APP) proteolüütilisest lõigust β-sekretaasi abil. See lõikamine tekitab 99 jäägi (CTF või C99) terminaalse karboksüfragmendi, mis lõigatakse seejärel β-sekretaasi abil erineva pikkusega Ap fragmentide saamiseks. On teada, et kõige rohkem Aβ liigid on Ap40 fragment. Teine teadaolev fragment, mis on moodustunud proteolüütilisest lõigust, vähem kui Aβ40, on Aβ42, mis on tõenäolisem amüloidfibrillide moodustamiseks, mis kogunevad Aβ liikidena Alzheimeri tõvega indiviidi ajus.
- Teist Alzheimeri tõve komponenti esindavad neurofibrillaarsed klastrid, mis koosnevad neuronite tsütoplasmas esinevatest filamentkiududest. Neurofibrillaarsed klastrid on lahustumatud ja näivad olevat resistentsed proteolüüsi protsesside suhtes in vivo, jäädes seeläbi koeosadesse isegi pikka aega pärast neuronaalset surma. Struktuuri vaadeldes moodustavad fibrillaarsed klastrid kahekordse spiraalfilamentkiududest ja sarnase koostisega lineaarsetest filamentidest. Kompositsiooni analüüsides valmistatakse topeltheliksi kiud enamasti hüperfosforüülitud tau valgust. Tau on mikrotuubulitega seotud aksonaalne valk, mis hõlbustab selle kokkupanemist.
Teised olulised neuropatoloogilised muutused Alzheimeri tõve all on mitokondriaalne düsfunktsioon, oksüdatiivne neuronaalne kahjustus, sünaptiline kaotus ja aksonaalne degeneratsioon.
Neurokeemilised aspektid
Nagu juba selgitatud, esindab Ap-peptiid, mis tuleneb APP prekursori proteolüütilisest lõikamisest , Alzheimeri tõve neurotoksilist komponenti . Täpsemalt on oletatud, et AP võib olla oluline normaalsete ajufunktsioonide jaoks ja kui see ületab teatud kontsentratsioonid, võib see muutuda neurotoksiliseks. Lisaks võivad nii AP kui ka erinevatel isovormidel olla erinev bioloogiline, füsioloogiline või patoloogiline roll, mis määravad ja osalevad haiguse järgmistes etappides. On täheldatud, et Ap toimib neuromodulaatorina, mõjutades mõnede neurotransmitterite vabanemist ilmse neurotoksilisuse tunnuste puudumisel.
Näiteks võib Ap neuromoduleeriv roll füsioloogilises kontekstis omada olulist tähendust neurotransmitteri süsteemi õige tasakaalu jaoks. On hästi teada, et see süsteem koosneb neurotransmitteritest, ainetest, mis edastavad informatsiooni närvisüsteemi moodustavate rakkude, neuronite vahel sünaptilise ülekande kaudu.
Patoloogilistes tingimustes võib Aβ-vahendatud sünaptiline ülekanne olla seotud neurotransmissiooni muutusega enne neurodegeneratiivseid sündmusi. Nende muutuste tagajärjel võivad tekkida varased kognitiivsed ja mitte-kognitiivsed häired, mis põhinevad mõjutatud neurotransmitterisüsteemidel ja erinevatel aju piirkondadel.
Neurotransmitterisüsteemide muutused ja signaaliülekande mehhanism Alzheimeri tõve all kannatavate isikute ajus on väga keerulised. Üks süsteem, mis näib muutuvat, puudutab kolinergilist signalisatsioonisüsteemi, mis hõlmab neurotransmitteri atsetüülkoliini. Tõepoolest, on näidatud, et Alzheimeri tõve all kannatavad isikud näitavad koliinergilise ülekande vähenemist ajukoorme ja hipokampuse tasemel, mis on olulised aju piirkonnad, mis on pühendatud sellistele nähtustele nagu õppimine ja mälu. Lisaks sellele neurotransmitterisüsteemile on Alzheimeri tõve korral täheldatud noradrenergiliste, serotonergiliste, glutamaadi ja GABA süsteemide muutusi.



