Trüpsiin ja kimotrüpsiin on kaks peamist ensüümi dieetvalkude seedimisel. Mõlemat toodetakse ja eritatakse kui zümogeene, st mitteaktiivses vormis kõhunäärme poolt; trüpsiini zümogeeni prekursorit nimetatakse trüpsinogeeniks, samas kui kimotrüpsiini nimetust nimetatakse kimotrüpsiiniks.
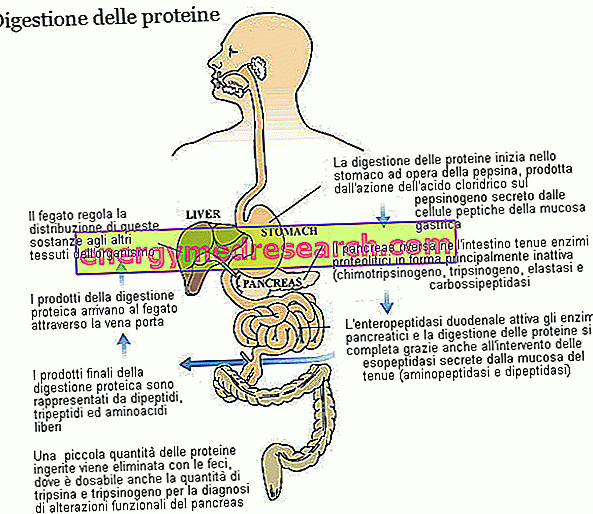
Trüpsiin ja kümotrüpsiin kuuluvad proteolüütiliste ensüümide suurtesse perekondadesse (osalevad valgu seedimises) ja endopeptidaasi alarühmas. Need ained - sealhulgas mao pepsiin ja pankrease elastaas - ründavad peptiidsidemeid aminohappe ahelas, põhjustades väiksemaid molekulaarseid fragmente. Teise rühma, eksopeptidaaside, ensüümid lõpetavad trüpsiini ja kimotrüpsiini töö, eraldades üksikud aminohapped peptiidahela otstest; Sellesse perekonda kuuluvad pankrease karboksüpeptidaasid (A1, A2 ja B, mis ründavad karboksüüli otsa), aga ka aminopeptidaasid (mis ründavad aminoterminaalset otsa) ja dipeptidaase, mida toodavad ja sekreteerivad peensoole limaskesta. Mõned karboksüpeptidaasid, mis on sarnased trüpsiini (trüpsinogeeni) ja kimotrüpsiini (kümotrüpsiin) puhul, sekreteerivad kõhunääre inaktiivses vormis. Kõigil kolmel juhul on ensüümi aktiveerimisprotsessis osalev ensüüm enteropeptidaas, kaksteistsõrmiksoole limaskesta rakkude poolt toodetud ja sekreteeritud valk; täpsemalt, enteropeptidaas on spetsiifiline trüpsinogeeni suhtes, mis pärast trüpsiiniks muundumist aktiveerib ka teisi proteolüütilisi ensüüme, kaasa arvatud trüpsiin.
Trüpsiini ja kimotrüpsiini vahelised funktsionaalsed erinevused puudutavad lihtsalt nende spetsiifilisust, st võimet ära tunda ja lagundada ainult hästi määratletud aminohapete poolt moodustunud sidemed. Trüpsiin sekkub peamiselt peptiidsidemete hulka, mis kasutavad aluselisi aminohappeid (nagu arginiin ja lüsiin), samas kui kümotrüpsiin hüdrolüüsib peamiselt türosiini, fenüülalaniini, trüptofaani, leutsiini ja metioniini sidemeid.
Tänu erinevatele proteolüütilistele ensüümidele lagunevad maohappesuse tõttu algselt mitmete kümnete aminohapete poolt moodustatud toitevalgud dipeptiidideks, tripeptiidideks ja vabadeks aminohapeteks, kõik kergesti imenduvad ained, mis pärinevad soole limaskesta kapillaaridest transporditakse maksa.
Trüpsiin ja kimotrüpsiin väljaheites
Kümotrüpsiini ja trüpsiini määramist väljaheidetes kasutatakse ja see oli eriti nii eksokriinse kõhunäärme funktsionaalse võimekuse kaudse testina. Kui midagi ei toimi selles nääreosas korralikult, on loogiline eeldada trüpsiini ja kimotrüpsiini vähenenud sünteesi, mis on ka väljaheites puudulik. Testil on hea tundlikkus, kuid koormab vale positiivsete ja valede negatiivsete riskide tegelik oht. Laksatiivide kasutamine vähendab näiteks ensüümide sisaldust väljaheites, samas kui seedetrakti pankreaseekstraktide (näiteks pankreatiini) või köögiviljade (nt ananassi varre, papaia, papaiini ja bromelain) põhjustavad vale negatiivseid tulemusi. Ka soolestiku bakteriaalne taimestik mõjutab veidi väljaheitega muutumatut trüpsiini ja kimotrüpsiini kogust; sel põhjusel võib antibiootikumide kasutamine tekitada vale negatiivseid tulemusi; vastupidi, divertikuloosi ja teiste bakterite proliferatsiooni soodustavate seisundite esinemise korral võib registreerida valepositiivseid tulemusi.
Trüpsiini ja kimotrüpsiini annuse klassikaline kasutamine väljaheites on pankrease puudulikkuse avastamine tsüstilise fibroosiga patsientidel. Selle haiguse üheks tagajärjeks on trüpsiini ja teiste seedetrakti ensüümide normaalse transpordi kahjustamine kõhunäärmest kaksteistsõrmiksoole; sel põhjusel on tsüstilise fibroosiga lapse väljaheited eriti kompaktsed, kuni need põhjustavad soole obstruktsiooni. Selle tulemusena registreeritakse mekoniumis eriti väikeses koguses kimotrüpsiini ja trüpsiini.



