üldsõnalisus
Müeloomi on pahaloomuline kasvaja, mis mõjutab teatud immuunsüsteemi rakke, tekitades kahjustusi erinevatele elunditele ja kudedele. Tavaliselt areneb see üle 50-aastastel inimestel, keda sageli kaasneb valu, luumurrud ja luu hävimine.
Müeloomil on diagnoositud vere- ja luuüdi testid, valgu elektroforees uriinis ja radioloogilised uuringud. Haiguste remissioone võib indutseerida steroidide, kemoteraapia, proteasoomi inhibiitorite, immunomoduleerivate ravimitega (nagu talidomiid või lenalidomiid) ja tüvirakkude siirdamisega.
põhjused
Müeloomi põhjustavad põhjused on osaliselt teadmata. Meditsiinilisest statistikast selgus, et ioniseeriva kiirgusega kokkupuutuvate isikute või teatud keemiliste ainete (nafta derivaadid ja muud süsivesinikud, lahustid, pestitsiidid, asbest jne) esinemissagedus suureneb. Mitme müeloomi etioloogias võivad osaleda ka perekonna geneetilised tegurid, korduv antigeenne stimulatsioon ja viirusained.
sümptomid
Lisateabe saamiseks: Müeloomi sümptomid
Müeloomi esineb peamiselt vanemas eas (üle 50 aasta). Märgid ja sümptomid võivad inimeselt oluliselt erineda, kuna haigus võib mõjutada paljusid elundeid. Alguses ei pruugi haigusseisund põhjustada sümptomeid. Haiguse progresseerumisel ilmnevad tõenäoliselt plasma rakkude elundite infiltratsiooniga seotud sümptomid ja monoklonaalsete immunoglobuliinide ülemäärane tootmine:
- Luudevalu. Luudevalu mõjutab peaaegu 70% hulgimüeloomiga patsientidest ja on kõige levinum sümptom. See asub peamiselt selgroo, vaagna, ribide, pikkade luude ja kolju juures. Algne sümptomaatika on "pseudoreumaatiline", samas kui äge ja püsiv lokaliseeritud valu võib viidata patoloogilisele luumurdule. Selgroo kaasamine võib viia seljaaju kompressioonini. Mitme müeloomi korral on luukahjustus sekundaarne "lüütilise" tüüpi kahjustuste ja osteopeenia ilmnemisel müelomaatsete plasma rakkude proliferatsiooniga medullaarses õõnsuses. Mitmekordse müeloomi rakud toodavad tegelikult mitmesuguseid tegureid (kogunevad OAF-i, Osteoklastide aktiveeriva faktoriga ), mis võimaldavad osteoklastidel luude koe lammutamist kiirendada imendumise teel. Kuna osteoblastid ("luu tootjad") ei allu samadele proliferatiivsetele stiimulitele, väheneb luumassi järk-järgult. See muudab koe struktuuri, muutes luud habras ja kalduvad luumurdudeks, osteoporoosiks ja purustamiseks (selgroolülid). Radioloogilisest vaatenurgast on luu ümberkorraldamine ilmne tänu "perforeeritud" täpidele, mis langevad kokku osteokondensatsiooni puuduvate aladega. Suurenenud luu kahjustused võivad samuti suurendada kaltsiumi vabanemist veres (hüperkaltseemia).
- Hüperkaltseemia . Kõrge kaltsiumisisaldus veres mõjutab närvide funktsiooni ja põhjustab liigset janu, iiveldust, kõhukinnisust, isu kaotust ja vaimset segadust. Hüperkaltseemia on tingitud pahaloomuliste rakkude infiltreerumisest luudesse.
- Neerupuudulikkus. Neerufunktsiooni konditsioneerimisel mõjutavad mitmed tegurid. Kõrged ebanormaalsete immunoglobuliinide tasemed, "monklonaalsed kõrvalekalded (valgud? M), võivad põhjustada tubulaarseid kahjustusi pärast nende ladestumist glomeruliinides (Bence Jones proteinuria). Suurenenud luu resorptsioon põhjustab hüperkaltseemiat ja põhjustab nefrocalcinosis, aidates seega kaasa neerupuudulikkusele. Muudeks põhjusteks on hüperurikeemiline nefropaatia (kusihappe sadestamisest), kasvajarakkude kohalik infiltratsioon, korduvad infektsioonid (püelonefriit) ja amüloidoos.
- Aneemia. Miteroomi korral on punaste vereliblede puudulikkus tingitud sellest, et luuüdi tuumorikloonide kasuks ei esine "terveid" vererakke. Aneemia võib põhjustada asteeniat, üldist nõrkust ja hingamisraskust.
Nendele neljale probleemile, mis on ühised hulgimüeloomile, viidatakse sageli lühendile CRAB, mis viitab kaltsiumi tasemele, neerupuudulikkusele, aneemiale ja luukahjustustele → C = kaltsium (kõrgenenud), R = neerupuudulikkus, A = aneemia, B = luu kahjustused
Teised hulgimüeloomi tunnused ja sümptomid võivad hõlmata järgmist:
- Infektsioonid : valgete vereliblede vähenemine (leukopeenia) põhjustab immuunpuudulikkust, seega madalamat resistentsust nakkuste vastu. Need võivad olla erineva kliinilise raskusastmega (kopsupõletik, sinusiit, naha-, põie- või neeruinfektsioonid) ning need on peamise hulgimüeloomiga patsientide surma põhjus. Infektsioonide tekkimise suurim risk hõlmab esimest kuud pärast keemiaravi algust.
- Hemostaasi muutused : trombotsüütide puudumine (trombotsütopeenia) põhjustab koagulatsiooniprotsessi muutusi, mis avaldub märkimisväärses veritsuse kalduvuses. Üldiselt on trombotsüütide poolväärtusaeg vähenenud ja koostoime vasal-endoteeliga muutunud. Muud hemostaasi kõrvalekalded tulenevad fibrinolüüsi vähenemisest.
- Hüperviskosündroomi sündroom : mitmel hulgimüeloomi korral suureneb plasmaviskoossuse väärtus, mis põhjustab hemorraagilisi sümptomeid, neuroloogilisi häireid ja südame isheemiat.
- Neuroloogilised häired : hulgimüeloomiga seotud neuroloogilised ilmingud on heterogeensed. Kõige tavalisemad sümptomid on neuriitiliste valude ilmumine ja jäsemete nõrkus või tuimus. Lõpuks võib esineda radikaalse valu ja seljaaju kompressiooni, mis on tingitud lülisamba kaasamisest, või karpaalkanali sündroomist ja teistest neuropaatiatest, mis on põhjustatud amüloidi ladestumisest perifeerse närvi tasemel.
diagnoos
Arst võib tuvastada hulgimüeloomi sümptomeid rutiinse füüsilise kontrolli käigus läbi viidud vere- ja uriinianalüüside abil. Kui patsient on asümptomaatiline, võib neid laboratoorsed testid korrapäraselt korrata, et jälgida haiguse arengut ja määrata parim aeg ravi alustamiseks. Organite kaasamine on hulgimüeloomi jaoks oluline diagnostiline kriteerium.
Laboratoorsed katsed
Paljudel juhtudel tuvastab vereanalüüs aneemia olemasolu (Hb <10g / dl). Perifeerse vere määrdumisega kaasneb punaste vereliblede (punaste vereliblede) kogunemine, mis on tingitud suurenenud plasma viskoossusest. Sageli eksisteerivad neutropeenia ja trombotsütopeenia, mis haiguse terminaalses faasis süveneb.
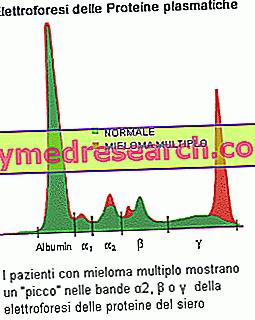
Seerumi valkude elektroforees on võimeline demonstreerima kasvaja klooni poolt toodetud paraproteiinide olemasolu: müeloomi kahtlus on põhjendatud, kui riba (piik) on elektroforeetilise profiili puhul oluline, komponent M> 30 g / L. Teine levinud leid on Bence Jones'i proteinuuria, mida iseloomustab paraproteiinide olemasolu uriinis, mis koosneb kergetest monoklonaalsetest ahelatest. M-komponendi kvantitatiivsed mõõtmised on vajalikud hulgimüeloomi diagnoosimiseks ja haiguse jälgimiseks. Vereanalüüsid suurendavad erütrotsüütide settimist (ESR) ja põhjustavad kaltsiumisisalduse muutusi (kaugelearenenud hulgimüeloomiga patsientidel kõrgenenud), albumiini (vähene korrelatsioon arenenud müeloomiga), kusihappe (urikaemia) ja kreatiniini taset (suurenemine) neerufunktsiooni vähenemise tõttu). Teie arst võib teha ka muid teste, et kontrollida beeta-2-mikroglobuliini, mis on müeloomi plasma rakkude poolt toodetud valk, olemasolu. See võib olla kasulik näitaja patsiendi lavastamisel: kõrged tasemed näitavad kaugelearenenud haigust ja halvemat prognoosi.
Pildindusmeetodid
Kiirgusuuring näitab skeleti kaasatust. Magnetresonantstomograafia on lüütiliste kahjustuste avastamisel tundlikum kui tavaline radiograafia ja suudab varakult määratleda luu ümberkorralduste olemasolu.
Luuüdi uuring
Luuüdi uuringud näitavad arvukalt plasma rakke: hulgimüeloomi määratluse diagnostiline nõue on see, et kasvaja kloonide kogus on suurem kui 10%. Osa proovist testitakse ka selleks, et hinnata iseloomulike kariotüübi muutuste esinemist, tavapäraste tsütogeneetikumide või fluorestsents-in situ hübridisatsioonitehnikate (FISH) kasutamisega. Kromosomaalsed anomaaliad, mida kõige sagedamini esineb hulgimüeloomi puhul, hõlmavad kromosoome 1, 3, 5, 11, 13 ja 14. Konkreetselt korreleerub kromosoomi 13 monosoom vähenenud ellujäämisega, mis on seotud suure proliferatsiooni ja ravimiresistentsusega.
Peatumine ja prognoos
Diagnostilised uuringud võivad kinnitada hulgimüeloomi kliinilist pilti. Lisaks võimaldavad nende testide tulemused arstil haiguse klassifitseerida 1., 2. või 3. staadiumis. 3. etapi müeloomi omavatel inimestel on üks või mitu kaugelearenenud haiguse märki, kaasa arvatud kasvaja kloonid ja neerupuudulikkus. Lisaks võimaldab luuüdi biopsia tulemus arst määrata patsiendi üldise riskiprofiili ja arendada parimat raviplaani.
| Mitme müeloomi astmestamine (vastavalt Durie-Salmonile) | ||
| Kliiniline etapp | parameetrid | Kasvaja mass (rakkude arv) |
| 1. etapp | Kõik järgnevad:
| <0, 5x1012 / m2 |
| 2. etapp | Ükski I ja III etapi kriteeriumidest | 0, 5-1, 2x1012 / m2 |
| 3. etapp | Üks või mitu järgmistest põhjustest:
| > 1, 2x1012 / m2 |
Durie-Salmoni lavastamissüsteemi etappe 1, 2 ja 3 võib jagada A või B, sõltuvalt seerumi kreatiniinist:
- A: kreatinineemia <2 mg / dl (<177 mmol / l)
- B: seerumi kreatiniinisisaldus> 2 mg / dl (> 177 mikromooli / l)
Hiljuti on välja pakutud veel üks peatusmehhanism, mida nimetatakse rahvusvaheliseks müeloomi peatamise süsteemiks .
Müeloomi rahvusvaheline prognostiline indeks (avaldatud International Staging System - 2005) | ||
staadion | kriteeriumid | Keskmine elulemus (kuud) |
| 62 | |
II | h42-mikroglobuliin <3, 5 mg / l ja albumiin <3, 5 g / dl või β2-mikroglobuliin 3, 5-5, 5 mg / l sõltumata seerumi albumiinist | 44 |
III | β2-mikroglobuliin ≥ 5, 5 mg / l | 29 |
ravi
Lisateabe saamiseks: Ravimid müeloomi raviks
Mitme müeloomi ravi on suunatud ravile, mis vähendavad klonaalset populatsiooni. Kui haigus on täiesti asümptomaatiline, piirdub ravi kliinilise vaatlusega. Sümptomite esinemisel võib ravi aidata leevendada valu, komplikatsioone, stabiliseerida seisundit ja aeglustada kasvaja arengut.
Esimese rea ravi
Viimastel aastatel on alla 65-aastastel patsientidel kõige sobivam terapeutiline valik autoloogse vereloome tüvirakkude siirdamise (autograft) suure annusega kemoteraapiaga. Enne siirdamist manustatakse indutseeriva kemoteraapia algtsükkel, mis on võimeline vähendama neoplastilist massi. Kõige sagedamini kasutatavad režiimid hõlmavad talidomiidi (+ deksametasooni), bortesomiibi ja lenalidomiidi (+ deksametasooni) manustamist. Kõrgtehnoloogilise kemoteraapia ja tüvirakkude toe (autotransplantatsioon) ravi ei ole tervendav, kuid võib pikendada üldist elulemust ja määrata täieliku remissiooni. Allogeenne tüvirakkude siirdamine, st tervelt inimeselt mõjutatud patsiendile, kujutab endast potentsiaalset ravi, kuid see on kättesaadav ainult väikese protsendi kliinilistest juhtudest. Üle 65-aastased patsiendid, kellel on märkimisväärne kaasnev haigus, ei talu sageli tüvirakkude siirdamist. Nende inimeste puhul hõlmab standardravi sageli keemiaravi melfalaaniga (4-7 päeva), mis on seotud prednisooniga (5–10 päeva), tsüklites, mida korratakse iga 6 nädala järel, millele järgneb puhkeaeg. Mõnel patsiendil võib olla kasulik selle protokolli seos uute ravirežiimidega, mis hõlmavad näiteks bortesomiibi manustamist. See ravim on proteasoomi inhibiitor (kõikides rakkudes esinev mitme valgu kompleks), mis võimaldab täielikku kliinilist vastust patsientidel, kellel on refraktaarne või kiiresti arenev haigus. Bortesomiibi toimemehhanism põhineb apoptoosi indutseerimisel kasvajarakkudes, blokeerides proteosoomide toimet. Oluline kliiniline vastus leiti ligikaudu 50% juhtudest
Toetav ravi
Lisaks hulgimüeloomi otsesele ravile manustatakse lüütiliste kahjustuste kontrollimiseks ja luumurdude vältimiseks regulaarselt bisfosfonaate (nt pamidronaat või zoledroonhape). Punaste rakkude põhised transfusioonid ja erütropoetiin on kasulikud aneemiaga seotud sümptomite korrigeerimiseks, samas kui trombotsüütide kontsentraatide manustamine võib takistada veritsust, mida põhjustab trombotsütopeenia. Steroidid ja bisfosfonaadid muutuvad hüperkaltseemiliste kriiside ravis oluliseks, samas kui antibiootikumid toetavad infektsioonide juhtimist.



